Адреналин (Adrenaline)
💊 Состав препарата Адреналин
✅ Применение препарата Адреналин
Описание активных компонентов препарата
Адреналин
(Adrenaline)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2021.12.01
Владелец регистрационного удостоверения:
Лекарственная форма
| Адреналин |
Р-р д/инъекц. 1 мг/1 мл: амп. 5, 10, 100, 250 или 500 шт. рег. №: ЛС-001849 |
Форма выпуска, упаковка и состав
препарата Адреналин
Вспомогательные вещества: натрия хлорид — 8 мг, натрия дисульфит (натрия метабисульфит) — 1 мг, хлорбутанол (в форме хлорбутанола гемигидрата) — 5 мг, динатрия эдетат (динатриевая соль этилендиаминтетрауксусной кислоты) — 0.5 мг, глицерол (глицерин) — 60 мг, хлористоводородная кислота — до pH 2.5-4, вода д/и — до 1 мл.
1 мл — ампулы (5) — упаковки контурные ячейковые (1) — пачки картонные.
1 мл — ампулы (5) — упаковки контурные ячейковые (2) — пачки картонные.
1 мл — ампулы (5) для стационаров — упаковки ячейковые контурные (20) — коробки картонные.
1 мл — ампулы (5) для стационаров — упаковки ячейковые контурные (50) — коробки картонные.
1 мл — ампулы (5) для стационаров — упаковки ячейковые контурные (100) — коробки картонные.
Фармакологическое действие
Адреномиметик, оказывает прямое стимулирующее действие на α- и β-адренорецепторы.
Под действием эпинефрина (адреналина) вследствие стимуляции α-адренорецепторов происходит увеличение содержания внутриклеточного кальция в гладких мышцах. Активация α1-адренорецепторов повышает активность фосфолипазы С (через стимуляцию G-белка) и образование инозитолтрифосфата и диацилглицерола. Это способствует высвобождению кальция из депо саркоплазматического ретикулума. Активация α2-адренорецепторов приводит к открытию кальциевых каналов и увеличению входа кальция в клетки.
Стимуляция β-адренорецепторов вызывает обусловленную G-белком активацию аденилатциклазы и увеличение образования цАМФ. Этот процесс является пусковым механизмом развития реакций со стороны различных органов-мишеней. В результате стимуляции β1-адренорецепторов в тканях сердца происходит увеличение внутриклеточного кальция. При стимуляции β2-адренорецепторов происходит уменьшение свободного внутриклеточного кальция в гладких мышцах, обусловленное с одной стороны увеличением его транспорта из клетки, а с другой — его накоплением в депо саркоплазматического ретикулума.
Оказывает выраженное действие на сердечно-сосудистую систему. Увеличивает частоту и силу сердечных сокращений, ударный и минутный объем сердца. Улучшает AV-проводимость, повышает автоматизм. Увеличивает потребность миокарда в кислороде. Вызывает сужение сосудов органов брюшной полости, кожи, слизистых оболочек, в меньшей степени — скелетных мышц. Повышает АД (главным образом систолическое), в высоких дозах повышает ОПСС. Прессорный эффект может вызвать кратковременное рефлекторное замедление ЧСС.
Эпинефрин (адреналин) расслабляет гладкие мышцы бронхов, понижает тонус и моторику ЖКТ, расширяет зрачки, способствует понижению внутриглазного давления. Вызывает гипергликемию и повышает содержание в плазме свободных жирных кислот.
Фармакокинетика
Метаболизируется при участии МАО и КОМТ в печени, почках, ЖКТ. T1/2 составляет несколько минут. Выводится почками.
Проникает через плацентарный барьер, не проникает через ГЭБ.
Выделяется с грудным молоком.
Показания активных веществ препарата
Адреналин
Аллергические реакции немедленного типа (в т.ч. крапивница, ангионевротический шок, анафилактический шок), развивающиеся при применении лекарственных средств, сывороток, переливании крови, употреблении пищевых продуктов, укусах насекомых или введении других аллергенов.
Бронхиальная астма (купирование приступа), бронхоспазм во время наркоза.
Асистолия (в т.ч. на фоне остро развившейся AV-блокады III степени).
Кровотечение из поверхностных сосудов кожи и слизистых оболочек (в т.ч. из десен).
Артериальная гипотензия, не поддающаяся воздействию адекватных объемов замещающих жидкостей (в т.ч. шок, травма, бактериемия, операции на открытом сердце, почечная недостаточность, хроническая сердечная недостаточность, передозировка лекарственных средств).
Необходимость удлинения действия местных анестетиков.
Эпизоды полной AV-блокады (с развитием синкопального состояния (синдром Морганьи-Адамса-Стокса)).
Гипогликемия (вследствие передозировки инсулина).
С целью остановки кровотечения.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Применяют п/к, в/м, в/в капельно, местно. Режим дозирования устанавливают индивидуально, в зависимости от показаний, клинической ситуации.
Местно применяют для остановки кровотечений — используют тампоны, смоченные раствором эпинефрина.
Побочное действие
Со стороны сердечно-сосудистой системы: стенокардия, брадикардия или тахикардия, сердцебиение, повышение или снижение АД; при применении в высоких дозах — желудочковые аритмии; редко — аритмия, боль в грудной клетке, отек легких.
Со стороны иммунной системы: ангионевротический отек, бронхоспазм, кожная сыпь, многоформная эритема.
Со стороны пищеварительной системы: тошнота, рвота.
Со стороны нервной системы: головная боль, тревожное состояние, тремор, тик, головокружение, нервозность, чувство усталости, психоневротические расстройства (психомоторное возбуждение, дезориентация, нарушение памяти, агрессивное или паническое поведение, шизофреноподобные расстройства, паранойя), нарушение сна, мышечные подергивания.
Со стороны мочевыделительной системы: редко — затрудненное и болезненное мочеиспускание (при гиперплазии предстательной железы).
Местные реакции: боль или жжение в месте в/м инъекции.
Прочие: гипокалиемия, повышенное потоотделение.
Противопоказания к применению
Повышенная чувствительность к эпинефрину; гипертрофическая обструктивная кардиомиопатия, тахиаритмия, фибрилляция желудочков, хроническая сердечная недостаточность 3-4 степени, феохромоцитома, острая и хроническая артериальная недостаточность, гиперкалиемия, шок неаллергического генеза (в т.ч. кардиогенный, травматический, геморрагический), холодовая травма, органические повреждения головного мозга, закрытоугольная глаукома; детский и подростковый возраст до 18 лет (кроме состояний непосредственно угрожающих жизни); беременность, период грудного вскармливания; одновременное применение ингаляционных средств для общей анестезии (галотана).
Эпинефрин в комбинации с местными анестетиками не применяют для местной анестезии пальцев рук и ног из-за риска ишемического повреждения тканей.
При неотложных состояниях все противопоказания являются относительными.
С осторожностью
Метаболический ацидоз, ИБС, артериальная гипертензия, гиперкапния, гипоксия, фибрилляция предсердий, желудочковая аритмия, легочная гипертензия, гиповолемия, инфаркт миокарда, окклюзионные заболевания сосудов (в т.ч. в анамнезе — артериальная эмболия, атеросклероз, болезнь Бюргера, диабетический эндартериит, болезнь Рейно), сахарный диабет, гипертиреоз, давняя бронхиальная астма и эмфизема, церебральный атеросклероз, болезнь Паркинсона, тетраплегия, судорожный синдром, гиперплазия предстательной железы и/или трудности при мочеиспускании; пожилой возраст; парезы и параличи, повышение сухожильных рефлексов при травме спинного мозга.
Применение при беременности и кормлении грудью
Противопоказан к применению при беременности и в период грудного вскармливания.
Применение у детей
Противопоказано применение у детей и подростков в возрасте до 18 лет (кроме состояний непосредственно угрожающих жизни).
Применение у пожилых пациентов
C осторожностью применяют у пациентов пожилого возраста. Резкое повышение АД при применении эпинефрина может приводить к развитию кровоизлияния, особенно у пожилых пациентов с сердечно-сосудистыми заболеваниями.
Особые указания
В период лечения рекомендовано определение концентрации ионов калия в сыворотке крови, измерение АД, диуреза, минутного объема кровотока, ЭКГ, центрального венозного давления, давления в легочной артерии и давления заклинивания в легочных капиллярах.
Чрезмерные дозы эпинефрина при инфаркте миокарда могут усилить ишемию путем повышения потребности миокарда в кислороде.
Эпинефрин увеличивает уровень глюкозы в плазме крови, в связи с чем при сахарном диабете требуются более высокие дозы инсулина и производных сульфонилмочевины.
Эпинефрин нецелесообразно применять длительно (сужение периферических сосудов, приводящее к возможному развитию некроза или гангрены).
Применение эпинефрина для коррекции артериальной гипотензии во время родов не рекомендуется, поскольку может задерживать вторую стадию родов; при введении в больших дозах для ослабления сокращения матки может вызвать длительную атонию матки с кровотечением. При прекращении лечения дозы следует уменьшать постепенно, т.к. внезапная отмена терапии может приводить к тяжелой артериальной гипотензии.
Резкое повышение АД при применении эпинефрина может приводить к развитию кровоизлияния, особенно у пожилых пациентов с сердечно-сосудистыми заболеваниями.
У пациентов с болезнью Паркинсона могут наблюдаться психомоторное возбуждение или временное ухудшение симптомов заболевания при применении эпинефрина, в связи с чем необходимо соблюдать осторожность при применении эпинефрина у данной категории лиц.
Не вводить повторно в одни и те же участки, во избежание развития некроза тканей.
Не рекомендуется введение эпинефрина в ягодичные мышцы.
Лекарственное взаимодействие
Антагонистами эпинефрина являются блокаторы α- и β-адренорецепторов.
Неселективные бета-адреноблокаторы потенцируют прессорный эффект эпинефрина.
При применении одновременно с сердечными гликозидами, хинидином, трициклическими антидепрессантами, допамином, средствами для ингаляционного наркоза (хлороформ, энфлуран, галотан, изофлуран, метоксифлуран), кокаином возрастает риск развития аритмий (одновременное применение не рекомендуется, за исключением случаев крайней необходимости); с другими симпатомиметическими средствами — усиление выраженности побочных эффектов со стороны сердечно-сосудистой системы; с антигипертензивными средствами (в т.ч. с диуретиками) — снижение их эффективности; с алкалоидами спорыньи — усиление вазоконстрикторного эффекта (вплоть до выраженной ишемии и развития гангрены).
Эпинефрин уменьшает эффекты гипогликемических средств (в т.ч. инсулина), нейролептиков, холиномиметиков, миорелаксантов, опиоидных анальгетиков, снотворных средств.
Эффективность применения эпинефрина снижена у пациентов с тяжелыми анафилактическими реакциями, принимающих β-адреноблокаторы. В этом случае в/в применяют сальбутамол.
Одновременное применение эпинефрина с ингибиторами МАО (прокарбазин, селегилин, а также фуразолидон) может вызывать внезапное и выраженное повышение АД, гиперпиретический криз, головную боль, аритмии, рвоту; с нитратами — ослабление их терапевтического действия. С феноксибензамином — усиление антигипертензивного действия и тахикардию; с фенитоином — внезапное снижение АД и брадикардию (зависит от дозы и скорости введения); с препаратами гормонов щитовидной железы — взаимное усиление действия.
Возможно удлинение интервала QT при одновременном применении эпинефрина со следующими препаратами: с антиаритмическими препаратами (такими как лидокаин, амиодарон, соталол), с антибиотиками (такими как эритромицин, левофлоксацин), с антигистаминными препаратами (такими как лоратадин, димедрол), с трициклическими и тетрациклическими антидепрессантами (такими как амитриптилин, имипрамин, сертралин, хлорпромазин), с нейролептиками (такими как галоперидол, рисперидон), с антагонистами допаминовых рецепторов (такими как домперидон), с противомалярийными препаратами (такими как хлорохин, мефлохин), с противогрибковыми препаратами (такими как кетоконазол, флуконазол), с антигипертензивными препаратами (такими как индапамид, эфедрин), может вызывать удлинение интервала QT.
Одновременное применение эпинефрина с диатриазиатами, йогаламовой или йоксагловой кислотами — усиление неврологических эффектов, с алкалоидами спорыньи может вызвать усиление вазоконстрикторного эффекта (вплоть до выраженной ишемии и развития гангрены).
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Introduction
Approximately 10% of newborns require some assistance to begin breathing at birth (1). Majority of these newborns improve without the need for cardiac compression or epinephrine if skillful positive-pressure ventilation is initiated in a timely manner. Less than 0.1% of all newborns require epinephrine, making epinephrine use in delivery room neonatal resuscitation an uncommon event (2, 3). Newborns who do require extensive cardiopulmonary resuscitation (CPR) including epinephrine have a high incidence of mortality. Those who survive frequently suffer from poor long-term neurodevelopmental outcomes (4–7).
The majority of recommendations regarding indication, dose, and route of administration of epinephrine in the delivery room are based on extrapolations from adult and animal studies. The infrequent use of epinephrine in the delivery room and ethical dilemmas in designing a clinical trial for examining the role of epinephrine during neonatal resuscitations make it very difficult to obtain high levels of evidence for recommendations regarding epinephrine use during neonatal resuscitation. Many of the animal and adult data come from a non-perfusion ventricular fibrillation arrest, which is not the pathophysiology of a newborn in the delivery room who suffers from an asphyxial arrest. Another major limitation of extrapolation from these studies is that newborns in the delivery room have unique transitional physiology including fluid-filled alveoli, an open ductus arteriosus, and high pulmonary pressures with limited pulmonary blood flow. Newly born infants must transition from fetal to newborn circulation. In the era of evidence-based medicine, due to lack of rigorous scientific evidence, proper use of epinephrine including dose and route of administration remains controversial. Even though epinephrine is not commonly needed in neonatal resuscitation, its association with death and poor prognosis raises questions as to whether optimization of epinephrine use and dosing, specifically tailored to the unique circumstances of the newly born infant, could improve outcomes.
This review aims to describe current recommendations for epinephrine use in neonatal resuscitation, the evidence behind such recommendations, and the critical knowledge gaps.
History of Epinephrine Use in Neonatal Resuscitation
Epinephrine is the only medication recommended during neonatal resuscitation in the delivery room (8, 9). Naloxone, sodium bicarbonate, and other vasopressors are currently not considered a part of acute resuscitation but can be used postresuscitation for special circumstances (9–11).
Management of the airway and assisted ventilation of the newborn baby can be found in ancient texts dating back to the Old Testament of the Bible, the Talmud, and Hippocrates (12, 13). However, reports of medication use in neonatal resuscitation can only be found after the early 1950s with the evolution of modern neonatology (13, 14). George Oliver and Edward Schaffer in 1893 first showed that adrenal glands contained a substance with distinct pharmacological properties (14, 15). It is a naturally occurring catecholamine produced by chromaffin cells at the adrenal medulla and stored in chromaffin granules. In 1897, John Abel in the United States prepared crude adrenal extracts and called them epinephrine (16). Epinephrine was used first time in pulseless patients in around 1906 by Crile and Dolley (17). Its resuscitative properties were further investigated by Wiggers in the 1930s and Redding and Pearson in the 1960s (18, 19).
Hemodynamic Effects of Epinephrine
Epinephrine stimulates all four adrenergic receptors (α1, α2, β1, and ß2) in vivo. When looked at in isolation, stimulation of the different adrenergic receptors by epinephrine results in different and sometimes opposing effects. It causes peripheral vasoconstriction via stimulation of α1 receptors in vascular smooth muscle cells. By stimulating β1 receptors in the myocardium, it causes chronotropy (increased heart rate), inotropy (increased contractility), dromotropy (increase conduction velocity), and lusitropy (increased rate of myocardial relaxation) (10, 20–22). Stimulation of α2 receptors leads to presynaptic inhibition of nor-epinephrine release in the central nervous system and vasoconstriction of coronary arteries. Through β2 receptor stimulation, it causes vascular smooth muscle relaxation and increased myocardial contractility, but these effects are usually minor. In vivo effects of epinephrine depend on the dose of epinephrine, number of receptors available on target tissues, the affinity of these receptors, and local target tissue environments (23).
Mechanism of Action During CPR
Initially it was believed that epinephrine causes return of spontaneous circulation (ROSC) in cardiac arrest via its myocardial stimulant effects (β adrenergic effects: chronotropic and inotropic) (10). In the 1960s, Redding demonstrated in dogs that the pure α-agonist, methoxamine, was as effective as epinephrine in achieving ROSC during CPR, whereas the pure β-agonist, isoproterenol, was no more effective than CPR alone (19). Otto et al. who used pretreatment with α-adrenergic blockade (phenoxybenzamine) and β-adrenergic blockade (propranolol) before infusing epinephrine confirmed that α-adrenergic stimulation is the most important action of epinephrine for ROSC in CPR (24).
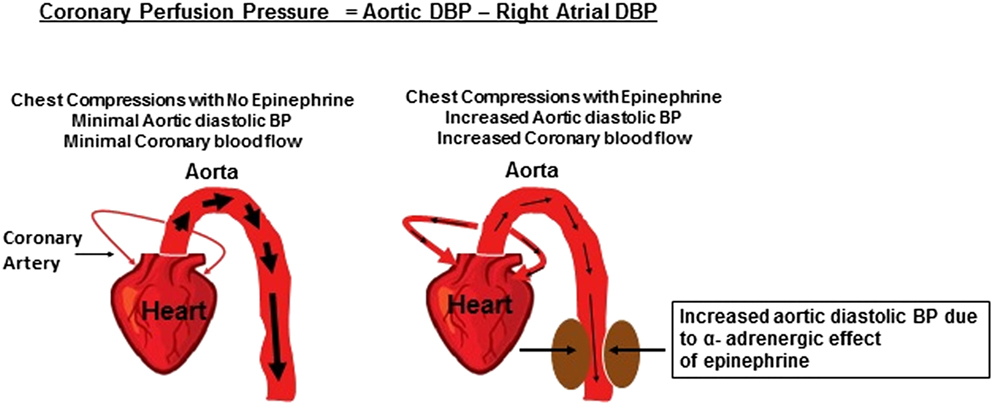
It is now established that the most reliable method for determining the effectiveness of CPR is to measure aortic diastolic blood pressure or coronary perfusion pressure (25). When heart muscles do not receive adequate blood flow and/or oxygen, their energy substrate is depleted. In turn, heart muscles stop contracting and the heart stops pumping. To restart the cardiac pump, it is critical that myocardial perfusion with oxygenated blood is reestablished. In acidotic asphyxiated neonates, there is loss of peripheral vascular tone, i.e., maximum vasodilation. When chest compressions are performed, blood from the cardiac chambers takes the path of least resistance and thus preferentially flows through aorta and into peripheral circulation rather than into narrow more constricted coronary arteries that have high resistance (Figure 1). The use of epinephrine in this situation results in intense peripheral vasoconstriction. This elevates the aortic to right atrial pressure gradient during the relaxation phase of CPR (26–29). Due to this pressure gradient, blood during chest compressions enters the coronary arteries and myocardial blood flow increases. Hence, this pressure gradient is called the coronary perfusion pressure. As oxygenated blood enters the coronary circulation, it facilitates resynthesis of adenosine triphosphate within myocardial mitochondria improving myocardial contractility and viability. In animal models and humans, coronary perfusion pressure correlates directly with myocardial blood flow, which is a good predictor of ROSC.
Figure 1. Epinephrine and coronary perfusion pressure.
Although minor, β2 receptor-mediated coronary vasodilation may contribute to improved coronary perfusion following epinephrine administration (10, 21, 30). Cerebral electrographic activity and cerebral oxygen uptake improves following epinephrine administration during CPR as cerebral blood flow increases due to epinephrine-induced peripheral vasoconstriction (28, 29). Through its α receptor stimulation, epinephrine may counteract carotid artery collapse induced by elevated intrathoracic pressures due to CPR and further optimize blood flow (28).
Studies utilizing posttransition asphyxia animal model have demonstrated the importance of epinephrine, where after asphyxia cardiac arrest, chest compressions alone were ineffective, but majority of animals reached the critical diastolic blood pressure (rising aortic to right atrial pressure gradient) and ROSC after epinephrine administration (31–33). It is important to note that these studies also showed that interruptions in chest compression lead to lowering of diastolic blood pressure, thus highlighting the importance of minimizing interruptions in cardiac compressions during CPR (31–33).
The majority of the above information was obtained from adult animal studies, posttransitioned neonatal animal studies, or human adult studies. No studies in term or preterm newborns or animal models with newborn transition physiology have investigated the mechanism of action of epinephrine during CPR. The distribution and maturation of α and β receptors in term and preterm newborns remain unknown (23).
Current Indication for Epinephrine During Neonatal CPR
Bradycardia in newly born infants is usually the result of inadequate aeration of lungs and ventilation or profound hypoxemia and acidosis from prior poor placental perfusion. Hence, effective ventilation is the top priority during delivery room resuscitation of the bradycardic newborn. Current resuscitation guidelines recommend that epinephrine should be used if the newborn remains bradycardic with heart rate <60 bpm after 30 s of what appears to be effective ventilation with chest rise, followed by 30 s of coordinated chest compressions and ventilations (1, 8, 9).
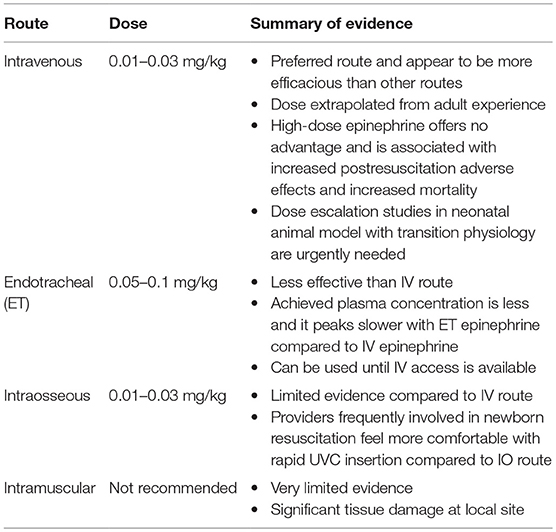
Optimal Dose and Route of Administration of Epinephrine During CPR
Epinephrine during neonatal CPR in the delivery room can be given by three routes: intravenous, endotracheal (ET), and intraosseous (Table 1).
Table 1. Epinephrine use during newborn resuscitation: route, dose, and summary of evidence.
Intravenous Epinephrine
This is the preferred route of administration during neonatal CPR in the delivery room as it appears to be more efficacious compared to other routes (1, 8, 9). The umbilical vein is a rapidly accessible, direct intravenous route. If epinephrine use is anticipated based on risk factors and no response to optimized positive-pressure ventilation (preferably via a secured airway), one team member should prepare to place an umbilical venous catheter, while the others continue to provide ventilation and chest compression. Chest compressions should be provided from head of the bed to allow adequate access to place the umbilical venous catheter (1).
The optimal dose of intravenous epinephrine has been the subject of much debate. In animal ventricular fibrillation models, Redding and Pearson demonstrated that intravenous epinephrine of 1 mg (0.1 mg/kg in 10 kg dogs) increased ROSC when combined with ventilation and chest compressions alone (19). Human studies following this study did not take into account the weight difference between the 10-kg dogs that were studied and the average adult weight, which is 7- to 10-fold more. Surprisingly, even with such low doses, epinephrine was reported to be effective in achieving ROSC in adult CPR (34). As there are no neonatal epinephrine dosing studies, the recommended dose was extrapolated from the adult experience with a suggested dosing range of 0.01–0.03 mg/kg. Given the overlooked weight difference between dogs in the study by Redding and Pearson (19) and humans, studies were conducted to see if higher dose epinephrine would be more efficacious. Initially, studies in ventricular fibrillation adult animal model showed increased ROSC and improved cerebral and coronary blood flow with escalating doses of epinephrine (35). Based on these data, adult and pediatric resuscitation guidelines started recommending using 0.1 mg/kg high dose of epinephrine if no response was seen with standard dose epinephrine (36). Clinical studies conducted later found that high-dose epinephrine (0.1 mg/kg) is not more effective and may be harmful (35, 37, 38).
Animal Data
Berg et al. in a pediatric asphyxia swine model demonstrated that high-dose epinephrine did not result in increased ROSC, and in fact, there was higher postresuscitation mortality (39). Burchfield et al. in a neonatal lamb model demonstrated that high-dose epinephrine reduced stroke volume and cardiac output (40). McCaul et al. demonstrated dose-related adverse outcomes with higher tachycardia, hypertension, mortality, and increased troponin with high-dose epinephrine in a rat model (41). Observation of hypertension following hypotension with high-dose epinephrine is especially important for preterm newborns who are vulnerable to development of intraventricular hemorrhage with fluctuations in blood pressure (42, 43).
Adult Data
Meta-analysis of randomized control trials in adult cardiac arrest patients demonstrated increased ROSC with high-dose epinephrine but no improvement in survival to hospital discharge (35).
Older Children
Perondi et al. randomized 68 children (mean age of 6 years) to either 0.1 versus 0.01 mg/kg for the second dose of epinephrine after failure of standard first dose (0.01 mg/kg) (38). This study demonstrated that ROSC rates were similar between both groups. Alarmingly, no child survived in the high-dose epinephrine group compared to 21% survival in the standard epinephrine group. Patterson et al. confirmed these findings that high-dose epinephrine did not confer any benefits but reduced survival when arrest was precipitated by asphyxia (37).
Neonatal Data
There is a stark absence of any neonatal studies including randomized controlled trials studying any dose of epinephrine. Halling et al. described in an observational study of 20% success rate with single standard dose of IV epinephrine. Multiple doses were needed by large number of newborns (3).
In summary, these data suggest that there is no advantage with high-dose epinephrine, and it is associated with postresuscitation hypertension, tachycardia, and increased mortality especially following cardiac arrest from asphyxia. Neonatal data remain sparse, and dose escalation studies in appropriate neonatal models with transition physiology are urgently needed.
ET Epinephrine
Although the ET route is readily available and less time consuming than establishing an intravenous or intraosseous access, it appears to be less effective (36, 44, 45). However, until intravenous access is available, some clinicians may choose to give epinephrine ET (1, 9). Currently, the recommended dose is 0.05–0.1 mg/kg, which is much higher than the recommended intravenous epinephrine dose (1, 9).
Adult Animal Data
Redding et al. were the first to suggest the use of ET epinephrine during cardiac arrest (46). In a ventricular fibrillation pig model, Crespo et al. compared 0.01 versus 0.1 mg/kg ET epinephrine doses (47). The study demonstrated that higher dose was able to achieve higher plasma concentrations of the drug but that did not translate to higher blood pressure. Roberts et al. also investigated different ET epinephrine doses and compared them with equivalent intravenous epinephrine doses (48). The study demonstrated that the peak concentration of epinephrine was found in 15 s after either route of administration, but with ET epinephrine, blood concentrations were more sustained. Importantly maximum plasma concentration achieved by ET epinephrine was one-tenth of the plasma concentration achieved by the intravenous route. Vali and Lakshminrusimha conducted a study of ET versus intravenous epinephrine in a fetal lamb model of asphyxia where animals had not yet transitioned to newborn circulation (49). They demonstrated that plasma epinephrine peaks much faster and higher compared to ET epinephrine although no difference in rates of ROSC was observed between either group.
Human Adult Data
Many retrospective adult case series have noted ET epinephrine to be less effective than IV epinephrine in achieving ROSC during CPR (36, 44, 45).
Neonatal Data
Four case series in neonates noted some evidence of absorption or cardiovascular improvement following ET epinephrine administration, but doses were 10 times higher than typical intravenous doses, and the majority of newborns had bradycardia, not asystole (50–52). Barber and Wyckoff reported on a retrospective review of all neonates who received epinephrine in the delivery room during the study period (2). The study demonstrated that the majority of infants received their first dose as ET epinephrine. They found that ET epinephrine dose of 0.01–0.03 mg/kg failed to re-establish HR > 60 bpm two-thirds of time. In the neonates who failed to respond to ET epinephrine, 77% of them responded to subsequent intravenous epinephrine. ET epinephrine efficacy may be limited in the newly born due to dilution by non-mobilized lung fluid. Elevated pulmonary arterial pressure in the presence of patent ductus arteriosus could result in right-sided cardiac output bypassing the lungs and thus limiting epinephrine absorption from the lung (23, 25). Based on this evidence, guidelines recommended an increase in ET epinephrine dosing from 0.01 to 0.03 to 0.05 to 0.1 mg/kg (1, 9). Halling et al. presented a retrospective review comparing the dosing from 0.03 to 0.05 mg/kg (3). They found no improvement in rates or time of ROSC with the higher ET epinephrine dose. It is possible that there may not be an optimal ET epinephrine dose. Current guidelines stress the importance of education, practice, and preparation to rapidly establish IV access in delivery room for newborns who need epinephrine during delivery room resuscitation (9).
Intraosseous Epinephrine
Simulation studies have shown that for inexperienced personnel, establishment of an intraosseous line was faster and easier than the placement of umbilical catheters (53). In a neonatal case series of 27 neonates who received intraosseous epinephrine for resuscitation, no short-term complications were demonstrated (54). Also many critical clinical outcomes were not described. Given the comfort level that can be achieved by neonatal providers for rapid placement of umbilical catheters and limited evidence regarding IO placement in delivery room, IV epinephrine is preferred (1).
Intramuscular Epinephrine
Mauch et al. demonstrated that 0.1 mg/kg of IM epinephrine resulted in similar ROSC and survival in infant piglet cardiac arrest model (55). Case reports indicate that intramuscular epinephrine of 0.02 mg/kg causes significant tissue damage at injection site (56). Currently, intramuscular epinephrine is not recommended for neonatal CPR.
Adverse Effects of Use of Epinephrine During CPR
Epinephrine especially with repeated doses or with high doses can cause postresuscitation hypertension and tachycardia (39, 57). This can result in injury to various organ systems especially in preterm neonates. Excess epinephrine due to its vasoconstrictive properties can impair blood flow to various organs such as kidneys and intestines. Epinephrine can also result in elevation of pulmonary arterial pressures and increase myocardial oxygen consumption and demand through its β adrenergic effects (58, 59). This may be detrimental especially in situations where hypoxia persists and oxygen delivery is impaired. It has also been associated with imbalance of various neurotransmitters such as gamma-aminobutyric acid, dopamine, serotonin, acetylcholine (60–63). It can impair blood–brain barrier and possibly decrease the threshold for seizures (62, 64).
Alternatives to Epinephrine in DR
Given the limitations of epinephrine in neonatal CPR, there is a great interest in finding other vasoconstrictors that have fewer detrimental side effects. Vasopressin has been studied in the adult literature as an alternative. Endogenous vasopressin levels were found to be higher in successfully resuscitated adults compared to those who died. Vasopressin through V1 receptors is a potent vasoconstrictor of blood vessels in the skin, skeletal muscle, and mesenteric blood vessels (10, 65, 66). It does not have any stimulant effect on the myocardium, and at low doses, it can vasodilate coronary, pulmonary, and cerebral vessels. Even though it has these theoretical benefits over epinephrine, in randomized control trials in adults, vasopressin has not found to be more effective than epinephrine (67). A cohort study on pediatric in-hospital cardiac arrest vasopressin was found to be less effective and associated with higher mortality (68). In neonatal piglet posttransition asphyxia model, McNamara et al. showed that vasopressin resulted in improved survival, lower postresuscitation troponin, and less hemodynamic compromise compared to epinephrine (69). No human neonatal data exist regarding vasopressin in CPR. Studies with neonatal animal models with transition physiology are urgently needed.
Other Considerations for Epinephrine in the Delivery Room
Interval between Doses
The current recommendation is to repeat the dose of IV epinephrine every 3–5 min if the heart rate remains less than 60 bpm (1, 9). Vali and Lakshminrusimha in a fetal lamb asphyxia model demonstrated an incremental increase in plasma epinephrine concentration with repeated IV epinephrine doses every 3–5 min (49). Warren et al. performed retrospective review of in-hospital cardiac arrest in adults and found the optimal interval to repeat dose to be 9–10 min instead of 3–5 min (70). Linner et al. gave epinephrine before chest compressions to bradycardic and severely asphyxiated newborn piglets and demonstrated that this strategy did not improve ROSC or cerebral circulation (71). More studies are needed to find out optimal interval between doses, but current evidence would suggest that more frequent or early epinephrine does not seem to be more beneficial.
Flush Volume after IV Epinephrine Dose through Low UVC
Currently recommended flush volume after IV epinephrine dose is 0.5–1 ml (1). Vali and Lakshminrusimha showed higher incidence of ROSC and faster ROSC with right atrial epinephrine compared to low UVC epinephrine in fetal lamb asphyxia model (49). It is possible that the currently recommended flush volume will deposit the epinephrine in umbilical vein but might not be enough to reach the heart. It is unclear if current flush volume is adequate and if higher flush volume may result in faster rise and higher epinephrine plasma concentrations. Studies are underway to answer this question.
Outcomes in Newborns Who Require Epinephrine in the Delivery Room
Cohort study data suggest that epinephrine is needed in <0.1% of all liver born deliveries (2, 3) although there is a large variation among different centers. Severe fetal acidemia, malpositioned ET tubes, and ineffective ventilator support contribute to the higher use of delivery room epinephrine (72, 73). Thus, it remains critical that neonatal providers focus on optimizing positive-pressure ventilation including placement of an alternate airway as a part of their ventilation corrective measures if a newborn is not responding to initial positive-pressure ventilation. Provision of effective ventilation that moves the chest should eliminate or reduce unnecessary intensive CPR. Term infants who require intensive CPR including multiple epinephrine doses and those whose Apgar score remain low at 10 min of life suffer from high incidence of death or poor neurodevelopmental outcomes (4, 5). In preterm infants due to lack of good evidence for use of epinephrine and its adverse effects of epinephrine especially postresuscitation hypertension, outcome data become even more important. Multiple retrospective observational studies have noted that preterm neonates requiring CPR and epinephrine have significantly lower survival, higher incidence of early onset sepsis, NEC, grade 3–4 intraventricular hemorrhage, cystic periventricular leukomalacia, bronchopulmonary dysplasia, and neurodevelopmental impairment (7, 74–76). These studies frequently suffer from small numbers and selection bias as the most compromised and sicker preterm neonates may require CPR but all studies point toward worse outcomes associated with extensive delivery room CPR. These data suggest that optimization of CPR and epinephrine use in delivery room has potential to impact outcomes significantly.
Conclusion
Epinephrine use in delivery room remains uncommon especially when neonatal providers focus on effective positive-pressure ventilation. Epinephrine use in delivery room is associated with high mortality and poor long-term outcomes. Recommendations regarding epinephrine use including dose and route are based mostly on extrapolation of data from animals or adult literature. Even the majority of available animal data come from ventricular fibrillation cardiac arrest models and posttransition models that have little in common with newborns in the delivery room. There is a scarcity of human neonatal term and preterm epinephrine data even in the form of observational studies. Based on the limited available literature, intravenous epinephrine is preferred to ET epinephrine. Clinical and animal studies in transition neonatal models are urgently needed to identify optimal indication, timing, dose, route, and alternatives to epinephrine in neonatal CPR.
Author Contributions
VK performed the literature review, created first draft of the article, revised the draft, and created and approved the final draft of the article. MW critically reviewed the first draft, revised the draft, approved the final draft of the article, and contributed substantially to this manuscript.
Conflict of Interest Statement
The authors declare that the research was conducted in the absence of any commercial or financial relationships that could be construed as a potential conflict of interest.
Funding
This work was supported by NICHD/NIH 1K23HD083511-01A1 (to VK).
References
1. Weiner GM, Zaichkin J. Textbook of Neonatal Resuscitation (NRP). 7th ed. Elk Grove Village, IL: American Academy of Pediatrics (2016).
Google Scholar
2. Barber CA, Wyckoff MH. Use and efficacy of endotracheal versus intravenous epinephrine during neonatal cardiopulmonary resuscitation in the delivery room. Pediatrics (2006) 118(3):1028–34. doi: 10.1542/peds.2006-0416
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Halling C, Sparks JE, Christie L, Wyckoff MH. Efficacy of intravenous and endotracheal epinephrine during neonatal cardiopulmonary resuscitation in the delivery room. J Pediatr (2017). doi:10.1016/j.jpeds.2017.02.024
CrossRef Full Text | Google Scholar
4. Chawla S, Foglia EE, Kapadia V, Wyckoff MH. Perinatal management: what has been learned through the network? Semin Perinatol (2016) 40(6):391–7. doi:10.1053/j.semperi.2016.05.006
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Laptook AR, Shankaran S, Ambalavanan N, Carlo WA, McDonald SA, Higgins RD, et al. Hypothermia Subcommittee of the NNRN. Outcome of term infants using Apgar scores at 10 minutes following hypoxic-ischemic encephalopathy. Pediatrics (2009) 124(6):1619–26. doi:10.1542/peds.2009-0934
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Wyckoff MH, Salhab WA, Heyne RJ, Kendrick DE, Stoll BJ, Laptook AR, et al. Outcome of extremely low birth weight infants who received delivery room cardiopulmonary resuscitation. J Pediatr (2012) 160(2):239–44.e2. doi:10.1016/j.jpeds.2011.07.041
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Harrington DJ, Redman CW, Moulden M, Greenwood CE. The long-term outcome in surviving infants with Apgar zero at 10 minutes: a systematic review of the literature and hospital-based cohort. Am J Obstet Gynecol (2007) 196(5): 463.e1–5. doi:10.1016/j.ajog.2006.10.877
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Perlman JM, Wyllie J, Kattwinkel J, Wyckoff MH, Aziz K, Guinsburg R, et al. Part 7: neonatal resuscitation: 2015 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Circulation (2015) 132(16 Suppl 1):S204–41. doi:10.1161/CIR.0000000000000276
CrossRef Full Text | Google Scholar
9. Wyckoff MH, Aziz K, Escobedo MB, Kapadia VS, Kattwinkel J, Perlman JM, et al. Part 13: neonatal resuscitation: 2015 American Heart Association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care (reprint). Pediatrics (2015) 136(Suppl 2):S196–218. doi:10.1542/peds.2015-3373G
CrossRef Full Text | Google Scholar
10. Weiner GM, Niermeyer S. Medications in neonatal resuscitation: epinephrine and the search for better alternative strategies. Clin Perinatol (2012) 39(4):843–55. doi:10.1016/j.clp.2012.09.005
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Wyckoff MH, Perlman J, Niermeyer S. Medications during resuscitation – what is the evidence? Semin Neonatol (2001) 6(3):251–9. doi:10.1053/siny.2001.0053
CrossRef Full Text | Google Scholar
12. Raju TN. History of neonatal resuscitation. Tales of heroism and desperation. Clin Perinatol (1999) 26(3):629–40, vi–vii.
PubMed Abstract | Google Scholar
13. Wyllie J, Niermeyer S. The role of resuscitation drugs and placental transfusion in the delivery room management of newborn infants. Semin Fetal Neonatal Med (2008) 13(6):416–23. doi:10.1016/j.siny.2008.04.017
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Iacovidou N, Vasileiou PV, Papalois A, Syggelou A, Bassareo PP, Xanthos T. Drugs in newborn resuscitation: the more we learn the least we use. Curr Med Chem (2012) 19(27):4606–16. doi:10.2174/092986712803306303
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Oliver GS, Schafer EA. On the physiological action of extract of the suprarenal capsules. J Physiol Lond (1894) 16:i–iv. 77.
Google Scholar
16. Aronson JK. “Where name and image meet” – the argument for “adrenaline”. BMJ (2000) 320(7233):506–9. doi:10.1136/bmj.320.7233.506
CrossRef Full Text | Google Scholar
17. Crile G, Dolley DH. An experimental research into the resuscitation of dogs killed by anesthetics and asphyxia. J Exp Med (1906) 8(6):713–25. doi:10.1084/jem.8.6.713
CrossRef Full Text | Google Scholar
18. Wiggers CJ. Cardiac massage followed by countershock in revival of mammalian ventricles from fibrillation due to coronary occlusion. Am J Physiol (1936) 116:161.
Google Scholar
19. Redding JS, Pearson JW. Evaluation of drugs for cardiac resuscitation. Anesthesiology (1963) 24:203–7. doi:10.1097/00000542-196303000-00008
CrossRef Full Text | Google Scholar
20. Devic E, Xiang Y, Gould D, Kobilka B. Beta-adrenergic receptor subtype-specific signaling in cardiac myocytes from beta(1) and beta(2) adrenoceptor knockout mice. Mol Pharmacol (2001) 60(3):577–83.
PubMed Abstract | Google Scholar
21. Kuznetsov V, Pak E, Robinson RB, Steinberg SF. Beta 2-adrenergic receptor actions in neonatal and adult rat ventricular myocytes. Circ Res (1995) 76(1):40–52. doi:10.1161/01.RES.76.1.40
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Polin RA, Abman SH. Fetal and Neonatal Physiology. 4th ed. Philadelphia: Elsevier/Saunders (2011).
Google Scholar
23. Pinto M, Solevag AL, O’Reilly M, Aziz K, Cheung PY, Schmolzer GM. Evidence on adrenaline use in resuscitation and its relevance to newborn infants: a non-systematic review. Neonatology (2016) 111(1):37–44. doi:10.1159/000447960
CrossRef Full Text | Google Scholar
25. Wyckoff MH. Neonatal cardiopulmonary resuscitation: critical hemodynamics. Neoreviews (2010) 11(3):e123–9. doi:10.1542/neo.11-3-e123
CrossRef Full Text | Google Scholar
26. Brown CG, Werman HA, Davis EA, Katz S, Hamlin RL. The effect of high-dose phenylephrine versus epinephrine on regional cerebral blood flow during CPR. Ann Emerg Med (1987) 16(7):743–8. doi:10.1016/S0196-0644(87)80566-8
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Burnett AM, Segal N, Salzman JG, McKnite MS, Frascone RJ. Potential negative effects of epinephrine on carotid blood flow and ETCO2 during active compression-decompression CPR utilizing an impedance threshold device. Resuscitation (2012) 83(8):1021–4. doi:10.1016/j.resuscitation.2012.03.018
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Michael JR, Guerci AD, Koehler RC, Shi AY, Tsitlik J, Chandra N, et al. Mechanisms by which epinephrine augments cerebral and myocardial perfusion during cardiopulmonary resuscitation in dogs. Circulation (1984) 69(4):822–35. doi:10.1161/01.CIR.69.4.822
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Schleien CL, Dean JM, Koehler RC, Michael JR, Chantarojanasiri T, Traystman R, et al. Effect of epinephrine on cerebral and myocardial perfusion in an infant animal preparation of cardiopulmonary resuscitation. Circulation (1986) 73(4):809–17. doi:10.1161/01.CIR.73.4.809
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Gao F, de Beer VJ, Hoekstra M, Xiao C, Duncker DJ, Merkus D. Both beta1- and beta2-adrenoceptors contribute to feedforward coronary resistance vessel dilation during exercise. Am J Physiol Heart Circ Physiol (2010) 298(3):H921–9. doi:10.1152/ajpheart.00135.2009
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Sobotka KS, Polglase GR, Schmolzer GM, Davis PG, Klingenberg C, Hooper SB. Effects of chest compressions on cardiovascular and cerebral hemodynamics in asphyxiated near-term lambs. Pediatr Res (2015) 78(4):395–400. doi:10.1038/pr.2015.117
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Solevag AL, Dannevig I, Wyckoff M, Saugstad OD, Nakstad B. Extended series of cardiac compressions during CPR in a swine model of perinatal asphyxia. Resuscitation (2010) 81(11):1571–6. doi:10.1016/j.resuscitation.2010.06.007
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Solevag AL, Dannevig I, Wyckoff M, Saugstad OD, Nakstad B. Return of spontaneous circulation with a compression:ventilation ratio of 15:2 versus 3:1 in newborn pigs with cardiac arrest due to asphyxia. Arch Dis Child Fetal Neonatal Ed (2011) 96(6):F417–21. doi:10.1136/adc.2010.200386
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Pearson JW, Redding JS. The role of epinephrine in cardiac resuscitation. Anesth Analg (1963) 42:599–606. doi:10.1213/00000539-196309000-00022
CrossRef Full Text | Google Scholar
36. Wyckoff MH, Perlman JM. Use of high-dose epinephrine and sodium bicarbonate during neonatal resuscitation: is there proven benefit? Clin Perinatol (2006) 33(1):141–51, viii–ix. doi:10.1016/j.clp.2005.11.016
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Patterson MD, Boenning DA, Klein BL, Fuchs S, Smith KM, Hegenbarth MA, et al. The use of high-dose epinephrine for patients with out-of-hospital cardiopulmonary arrest refractory to prehospital interventions. Pediatr Emerg Care (2005) 21(4):227–37. doi:10.1097/01.pec.0000161468.12218.02
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Perondi MB, Reis AG, Paiva EF, Nadkarni VM, Berg RA. A comparison of high-dose and standard-dose epinephrine in children with cardiac arrest. N Engl J Med (2004) 350(17):1722–30. doi:10.1056/NEJMoa032440
CrossRef Full Text | Google Scholar
39. Berg RA, Otto CW, Kern KB, Hilwig RW, Sanders AB, Henry CP, et al. A randomized, blinded trial of high-dose epinephrine versus standard-dose epinephrine in a swine model of pediatric asphyxial cardiac arrest. Crit Care Med (1996) 24(10):1695–700. doi:10.1097/00003246-199610000-00016
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Burchfield DJ, Preziosi MP, Lucas VW, Fan J. Effects of graded doses of epinephrine during asphxia-induced bradycardia in newborn lambs. Resuscitation (1993) 25(3):235–44. doi:10.1016/0300-9572(93)90120-F
PubMed Abstract | CrossRef Full Text | Google Scholar
41. McCaul CL, McNamara PJ, Engelberts D, Wilson GJ, Romaschin A, Redington AN, et al. Epinephrine increases mortality after brief asphyxial cardiac arrest in an in vivo rat model. Anesth Analg (2006) 102(2):542–8. doi:10.1213/01.ane.0000195231.81076.88
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Noori S, Seri I. Hemodynamic antecedents of peri/intraventricular hemorrhage in very preterm neonates. Semin Fetal Neonatal Med (2015) 20(4):232–7. doi:10.1016/j.siny.2015.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Volpe JJ, editor. Intracranial hemorrhage: germinal matrix-intraventricular hemorrhage. Neurology of the Newborn. Philadelphia: Saunders (2008). 517 p.
Google Scholar
44. Niemann JT, Stratton SJ, Cruz B, Lewis RJ. Endotracheal drug administration during out-of-hospital resuscitation: where are the survivors? Resuscitation (2002) 53(2):153–7. doi:10.1016/S0300-9572(02)00004-7
PubMed Abstract | CrossRef Full Text | Google Scholar
45. Quinton DN, O’Byrne G, Aitkenhead AR. Comparison of endotracheal and peripheral intravenous adrenaline in cardiac arrest. Is the endotracheal route reliable? Lancet (1987) 1(8537):828–9.
Google Scholar
46. Redding JS, Asuncion JS, Pearson JW. Effective routes of drug administration during cardiac arrest. Anesth Analg (1967) 46(2):253–8. doi:10.1213/00000539-196703000-00033
CrossRef Full Text | Google Scholar
47. Crespo SG, Schoffstall JM, Fuhs LR, Spivey WH. Comparison of two doses of endotracheal epinephrine in a cardiac arrest model. Ann Emerg Med (1991) 20(3):230–4. doi:10.1016/S0196-0644(05)80928-X
PubMed Abstract | CrossRef Full Text | Google Scholar
48. Roberts JR, Greenberg MI, Knaub MA, Kendrick ZV, Baskin SI. Blood levels following intravenous and endotracheal epinephrine administration. JACEP (1979) 8(2):53–6. doi:10.1016/S0361-1124(79)80036-2
PubMed Abstract | CrossRef Full Text | Google Scholar
49. Vali P, Lakshminrusimha S. Epinephrine in Neonatal Resuscitation in a Term Lamb Model of Perinatal Asphyxial Arrest. Baltimore, MD: Pediatric Academic Society (2015).
Google Scholar
50. Jankov RP, Asztalos EV, Skidmore MB. Favourable neurological outcomes following delivery room cardiopulmonary resuscitation of infants < or = 750 g at birth. J Paediatr Child Health (2000) 36(1):19–22. doi:10.1046/j.1440-1754.2000.00434.x
CrossRef Full Text | Google Scholar
52. Schwab KO, von Stockhausen HB. Plasma catecholamines after endotracheal administration of adrenaline during postnatal resuscitation. Arch Dis Child Fetal Neonatal Ed (1994) 70(3):F213–7. doi:10.1136/fn.70.3.F213
PubMed Abstract | CrossRef Full Text | Google Scholar
53. Abe KK, Blum GT, Yamamoto LG. Intraosseous is faster and easier than umbilical venous catheterization in newborn emergency vascular access models. Am J Emerg Med (2000) 18(2):126–9. doi:10.1016/S0735-6757(00)90001-9
PubMed Abstract | CrossRef Full Text | Google Scholar
55. Mauch J, Ringer SK, Spielmann N, Weiss M. Intravenous versus intramuscular epinephrine administration during cardiopulmonary resuscitation – a pilot study in piglets. Paediatr Anaesth (2013) 23(10):906–12. doi:10.1111/pan.12149
PubMed Abstract | CrossRef Full Text | Google Scholar
56. Doglioni N, Chiandetti L, Trevisanuto D. Intramuscolar epinephrine during neonatal resuscitation. Resuscitation (2015) 90:e5. doi:10.1016/j.resuscitation.2014.08.039
CrossRef Full Text | Google Scholar
57. Hilwig RW, Kern KB, Berg RA, Sanders AB, Otto CW, Ewy GA. Catecholamines in cardiac arrest: role of alpha agonists, beta-adrenergic blockers and high-dose epinephrine. Resuscitation (2000) 47(2):203–8. doi:10.1016/S0300-9572(00)00261-6
CrossRef Full Text | Google Scholar
58. Hornchen U, Schuttler J, Stoeckel H, Eichelkraut W, Hahn N. Endobronchial instillation of epinephrine during cardiopulmonary resuscitation. Crit Care Med (1987) 15(11):1037–9. doi:10.1097/00003246-198711000-00009
PubMed Abstract | CrossRef Full Text | Google Scholar
59. Tang W, Weil MH, Sun S, Noc M, Yang L, Gazmuri RJ. Epinephrine increases the severity of postresuscitation myocardial dysfunction. Circulation (1995) 92(10):3089–93. doi:10.1161/01.CIR.92.10.3089
PubMed Abstract | CrossRef Full Text | Google Scholar
60. Anju TR, Abraham PM, Antony S, Paulose CS. Alterations in cortical GABAB receptors in neonatal rats exposed to hypoxic stress: role of glucose, oxygen, and epinephrine resuscitation. Mol Cell Biochem (2010) 343(1–2):1–11. doi:10.1007/s11010-010-0491-9
PubMed Abstract | CrossRef Full Text | Google Scholar
61. Anju TR, Korah PK, Jayanarayanan S, Paulose CS. Enhanced brain stem 5HT(2)A receptor function under neonatal hypoxic insult: role of glucose, oxygen, and epinephrine resuscitation. Mol Cell Biochem (2011) 354(1–2):151–60. doi:10.1007/s11010-011-0814-5
CrossRef Full Text | Google Scholar
62. Chathu F, Krishnakumar A, Paulose CS. Acetylcholine esterase activity and behavioral response in hypoxia induced neonatal rats: effect of glucose, oxygen and epinephrine supplementation. Brain Cogn (2008) 68(1):59–66. doi:10.1016/j.bandc.2008.02.124
PubMed Abstract | CrossRef Full Text | Google Scholar
63. Joseph B, Nandhu MS, Paulose CS. Dopamine D1 and D2 receptor functional down regulation in the cerebellum of hypoxic neonatal rats: neuroprotective role of glucose and oxygen, epinephrine resuscitation. Pharmacol Res (2010) 61(2):136–41. doi:10.1016/j.phrs.2009.08.007
PubMed Abstract | CrossRef Full Text | Google Scholar
64. Johansson BB, Martinsson L. Blood-brain barrier to albumin in awake rats in acute hypertension induced by adrenaline, noradrenaline or angiotensin. Acta Neurol Scand (1979) 60(4):193–7. doi:10.1111/j.1600-0404.1979.tb02969.x
PubMed Abstract | CrossRef Full Text | Google Scholar
67. Morrison LJ, Deakin CD, Morley PT, Callaway CW, Kerber RE, Kronick SL, et al. Part 8: advanced life support: 2010 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Circulation (2010) 122(16 Suppl 2):S345–421. doi:10.1161/CIRCULATIONAHA.110.971051
CrossRef Full Text | Google Scholar
68. Duncan JM, Meaney P, Simpson P, Berg RA, Nadkarni V, Schexnayder S, et al. Vasopressin for in-hospital pediatric cardiac arrest: results from the American Heart Association National Registry of Cardiopulmonary Resuscitation. Pediatr Crit Care Med (2009) 10(2):191–5. doi:10.1097/PCC.0b013e31819a36f2
CrossRef Full Text | Google Scholar
69. McNamara PJ, Engelberts D, Finelli M, Adeli K, Kavanagh BP. Vasopressin improves survival compared with epinephrine in a neonatal piglet model of asphyxial cardiac arrest. Pediatr Res (2014) 75(6):738–48. doi:10.1038/pr.2014.38
PubMed Abstract | CrossRef Full Text | Google Scholar
70. Warren SA, Huszti E, Bradley SM, Chan PS, Bryson CL, Fitzpatrick AL, et al. Adrenaline (epinephrine) dosing period and survival after in-hospital cardiac arrest: a retrospective review of prospectively collected data. Resuscitation (2014) 85(3):350–8. doi:10.1016/j.resuscitation.2013.10.004
PubMed Abstract | CrossRef Full Text | Google Scholar
71. Linner R, Werner O, Perez-de-Sa V, Cunha-Goncalves D. Early adrenaline administration does not improve circulatory recovery during resuscitation from severe asphyxia in newborn piglets. Resuscitation (2012) 83(10):1298–303. doi:10.1016/j.resuscitation.2012.02.030
CrossRef Full Text | Google Scholar
72. Kapadia VS, Wyckoff MH. Drugs during delivery room resuscitation – what, when and why? Semin Fetal Neonatal Med (2013) 18(6):357–61. doi:10.1016/j.siny.2013.08.001
CrossRef Full Text | Google Scholar
73. Perlman JM, Risser R. Cardiopulmonary resuscitation in the delivery room. Associated clinical events. Arch Pediatr Adolesc Med (1995) 149(1):20–5. doi:10.1001/archpedi.1995.02170130022005
CrossRef Full Text | Google Scholar
74. Frontanes A, Garcia-Fragoso L, Garcia I, Rivera J, Valcarcel M. Outcome of very-low-birth-weight infants who received epinephrine in the delivery room. Resuscitation (2011) 82(4):427–30. doi:10.1016/j.resuscitation.2010.11.020
PubMed Abstract | CrossRef Full Text | Google Scholar
75. Handley SC, Sun Y, Wyckoff MH, Lee HC. Outcomes of extremely preterm infants after delivery room cardiopulmonary resuscitation in a population-based cohort. J Perinatol (2015) 35(5):379–83. doi:10.1038/jp.2014.222
PubMed Abstract | CrossRef Full Text | Google Scholar
76. Shah PS, Shah P, Tai KF. Chest compression and/or epinephrine at birth for preterm infants <32 weeks gestational age: matched cohort study of neonatal outcomes. J Perinatol (2009) 29(10):693–7. doi:10.1038/jp.2009.70
CrossRef Full Text | Google Scholar
Прозрачный бесцветный раствор.
Действующее вещество: эпинефрина гидротартрат 1,82 мг;
Вспомогательные вещества: натрия метабисульфит (Е 223), натрия хлорид, вода для инъекций.
Средства, влияющие на сердечно-сосудистую систему. Негликозидные кардиотонические средства. Адренергические и допаминергические препараты. Эпинефрин.
Код АТС С01С А24.
Аллергические реакции немедленного типа: анафилактический шок, развившийся при применении лекарственных средств, сывороток, переливании крови, укусах насекомых или контакте с аллергенами.
Бронхиальная астма-купирование приступа.
Симпатомаческая артериальная гипотензия.
Гипогликемическая кома вследствие передозировки инсулина.
Асистолия, остановка сердца.
Продление действия местных анестетиков.
AV блокада III степени, остро развившаяся.
Повышенная чувствительность к эпинефрину гидротартрату или любому из вспомогательных компонентов лекарственного средства;
артериальная или легочная гипертензия;
выраженный атеросклероз;
стенокардия, инфаркт миокарда, коронарная недостаточность;
аневризмы;
тахиаритмия, фибрилляция желудочков или предсердий;
метаболитический ацидоз;
гипоголемия;
шок неаллергического генеза;
окклюзивные заболевания сосудов;
судорожный синдром;
тиреотоксикоз;
феохромоцитома;
сахарный диабет;
закрытоугольная глаукома;
беременность, второй период родов;
наркоз ингаляционными средствами для общей анестезии (фторотаном, циклопропаном, хлороформом);
при местной анестезии на участках пальцев рук и ног, носа и гениталий.
Способ применения и дозы
Назначают внутримышечно, подкожно, иногда — внутривенно (капельно), внутрисердечно (проведение реанимации при остановке сердца). При внутримышечном введении действовать начинает быстрее, чем при подкожном. Режим дозирования индивидуальный.
Взрослые
Анафилактический шок: вводят внутривенно медленно 0,5 мл, разведенные в 20 мл 40% раствора глюкозы. В дальнейшем, при необходимости, продолжают внутривенное капельное введение со скоростью 1 мкг/мин, для чего 1 мл раствора адреналина растворяют в 400 мл изотонического натрия хлорида или 5% глюкозы. Если состояние пациента допускает, лучше проводить внутримышечное или подкожное введение 0,3-05 мл в разведенном или неразведанном виде.
Бронхиальная астма: вводят подкожно 0,3-0,5 мл в разведенном или неразведенном виде. При необходимости повторного введения эту дозу можно вводить через каждые 20 минут ( до 3 раз). Возможно внутривенное введение 0,3-0,5 мл в разведенном виде.
Как сосудосуживающее средство вводят внутривенно капельно со скоростью 1 мкг/мин ( с возможным увеличением до 2-10 мкг/мин).
Асистолия: вводят внутрисердечно 0,5 мл, разведенных в 10 мл 0,9 % раствора натрия хлорида. Во время реанимационных мер — по 1 мл ( в разведенном виде) внутривенно медленно каждые 3-5 минут.
Дети
Асистолия у новорожденных: вводят внутривенно 10-30 мкг/кг массы тела каждые 3-5 минут, медленно.
Анафилактический шок: вводят подкожно или внутримышечно по 10 мкг/кг массы тела (максимально до 0,3 мг). При необходимости введения повторяют через каждые 15 минут (до 3 раз). I
Бронхспазм: вводят подкожно 10 мкг/кг массы тела ( максимально — до 0,3 мг). При необходимости введения повторяют каждые 15 минут (до 3-4 раз) или каждые 4 часа.
Кардиальные нарушения: стенокардия, брадикардия или тахикардия, ощущение сердцебиения, одышга; при высоких дозах — желудочковые аритмии; редко — аритмия, боль в грудной клетке, изменения ЭКГ (включая снижение амплитуды зубца Т).
Сосудистые расстройства: снижение или повышение артериального давления ( даже при подкожном введении в обычных дозах вследствие повышения артериального давления возможно субарахноидальное кровоизлияние и гемиплегия).
Неврологические расстройства: головная боль, тремор, головокружение, нервозность, мышечные подергивания; у пациентов с болезнью Паркинсона возможно повышение ригидности и тремора.
Психические расстройства: тревожное состояние, психоневротические “расстройства, психомоторное возбуждение, дезориентация, нарушение памяти, агрессивное или паническое поведение, шизофреноподобные расстройства, паранойя, нарушение сна.
Желудочно-кишечные расстройства: тошнота, рвота, анорексия.
Расстройства со стороны мочевыделительной системы: редко — затрудненное и болезненное мочеиспускание ( при гиперплазии предстательной железы).
Изменения со стороны кожи и подкожной клетчатки: кожная сыпь, мультиформная эритема.
Нарушения обмена веществ, метаболизма: гипокалиемия, гипергликемия.
Нарушения со стороны иммунной системы: ангионевротический отек, бронхоспазм.
Местные реакции: боль и жжение в месте внутримышечной инъекции.
Прочее: усталость, повышенное потоотделение, нарушение терморегуляции (похолодание или жар), похолодание конечностей, при повторных инъекциях адреналина может отмечаться некроз вследствие сосудосуживающего действия адреналина (включая некроз печени и почек).
Симптомы: чрезмерное повышение артериального давления, тахиаритмия, сменяющаяся брадикардией, нарушение сердечного ритма ( в том числе фибрилляция предсердий и желудочков), похолодание и бледность кожных покровов, рвота, страх, беспокойство, тремор, головная боль, метаболический ацидоз, инфаркт миокарда, черепно-мозговое кровоизлияние (особенно у пациентов пожилого возраста), отёк лёгких, почечная недостаточность, летальный исход. При введении в больших дозах ( минимальная летальная роза при подкожном введении 10 мл 1,8 мг/мл раствора) развивается мидриаз, значительное повышение артериальное давление, тахикардия с возможным переходом в фибрилляцию желудочков.
Лечение: прекращение введения лекарственного средства. Передозировку адреналина можно устранить применением α- и β-адреноблокаторов, быстродействующими нитратами. При тяжелых осложнениях необходима комплексная терапия. При аритмии назначают парентеральное введение β-адреноблокаторов.
Контролируемые исследования по применению адреналина беременным не проводились. Не применяют во время родов для коррекции гипотензии, поскольку лекарственное Средство может задерживать второй период родов за счет расслабления мышц матки. При введении в больших дозах для ослабления сокращения матки может вызвать длительную атонию матки с кровотечением.
При необходимости применения лекарственного средства следует прекратить кормление грудью.
Дети
Лекарственное средство применяют детям. Рекомендации о дозировании лекарственного средства детям приведены в разделе «Способ применения и дозы».
Внутрисердечно вводится при асистолии, если другие способы ее устранения недоступны, при этом существует повышенный риск развития тампонады-сердца и пневмоторакса.
При необходимости проведения инфузии следует использовать прибор с измерительным приспособлением с целью регулирования скорости инфузии. Инфузию следует проводить в крупную, лучше в центральную вену.
При проведении инфузии рекомедуется проведение мониторинга концентрации К* в сыворотке крови, артериального давления, диуреза, ЭКГ, центрального венозного давления, давления в легочной артерии.
Применение лекарственного средства больным сахарным диабетом увеличивает глекемию, в связи с чем требуются более высокие дозы инсулина или производных сульфонилмочевины.
Адреналин нежелательно применять длительно, поскольку сужение периферических сосудов может приводить к развитию некроза или ганглены.
При прекращении лечения дозу адреналина следует уменьшать постепенно, так как внезапная отмена терапии можег приводить к тяжелой гипотензии.
С осторожностью применять при гипокалиемии, гиперкальциемии.
С осторожностью применять больным с желудочковой аритмией, ишемической болезнью сердца, фибрилляцией предсердий, артериальной гипертензией, легочной гипертензией, при инфаркте миокарда ( в случае возникновения необходимости применения лекарственного средства при инфаркте миокарда следует помнить, что адреналин может усиливать ишемию за счет повышения потребности миокарда в кислороде), метаболическим ацидозом, гиперкапнией, гипоксией, гиповолемией, тиреотоксикозом, у пациентов с окклюзионными заболеваниями сосудов (артериальная эмболия, атеросклероз, болезнь Бюргера, холодовая травма, диабетический эндаргериит, болезнь Рейно; поскольку существует риск возникновения некроза и гангрены, необходимо контролировать состояние периферического кровообращения), с церебральным атеросклерозом, болезнью Паркинсона, судорожным синдромом, гипертрофией предстательной железы.
При гиповолемии перед применением симпатомиметиков необходимо провести соответствующую гидратацию пациентов.
В период лечения лекарственным средством не рекомендуется управление автотранспортом и занятие другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и скорости психомоторных реакций.
Антагонистами эпинефрина являются блокаторы α- и β-адренорецепторов; α- адреноблокаторы, такие как фентоламин, препятствуют сосудосуживающему и гипертоническому эффектам эпинефрина, что может быть полезным при передозировке эпинефрина. β-адреноблокаторы, особенно неселективные, препятствуют сердечным и бронхолитическим эффектам эпинефрина.
Пациенты с тяжелой анафилаксией, принимающие неселективные β-адреноблокаторы, могут не реагировать на введение эпинефрина.
При одновременном применении лекарственного средства Адреналин с другими лекарственными средства ми возможно:
с наркотическими анальгетиками и снотворными лекарственными средствами — ослабление их эффектов;
с сердечными гликозидами, хинидинам, трициклическими антидепрессантами^ допамином, средствами для ингаляционного наркоза (хлороформ, энфлуран, галотан, изофлурану метоксифлуран), кокаином — повышение риска развития аритмий;
с другими симпатомиметическими средствами — усиление выраженности побочных эффектов со стороны сердечно-сосудистой системы;
с антигипертензивными средствами (в т.ч. с диуретиками) — снижение их эффективности;
с ингибиторами моноаминоксидазы (включая фуразолидон, прокарбазин, смегитал) — внезапное и выраженное повышение артериального давления, гиперпиретический криз, головная боль, аритмии сердца, рвота;
с нитратами — ослабление их терапевтического действия; — ,
с феноксибензамином — усиление гипотензивного эффекта и тахикардия;
с фенитоином — внезапное снижение артериального давления и брадикардия, зависящее от дозы и скорости введения адреналина;
с препаратами гормонов щитовидной железы — взаимоное,усиление действия;
с астемизолом, цизапридом, терфенадином — удлинение Q-T- интервала на ЭКГ;
с диатризоатамами, йоталамовой или йоксагловой кислотами — усиление неврологических эффектов;
с алкалоидами спорыньи — усиление вазоконстрикторного эффекта вплоть до выраженной
ишемии и развития гангрены;
с гипогликемическими лекарственными средствами (включая инсулин) — снижение гипогликемического эффекта;
с препаратами, вызывающими потерю калия, в том числе с кортикостероидами, петлевыми
диуретиками, аминофиллином и теофиллином — потенцирование гипокалиемического эффекта.
Фармакодинамика. Адреналин — кардиостимулирующее, сосудосуживающее, гипертензивное, антигипогликемическое средство.
Лекарственное средство стимулирует α- и β-адренорецепторы различной локализации. Проявляет выраженное действие на гладкие мышцы внутренних органов, сердечно-сосудистую- и дыхательную системы, активирует углеодный илипидный обмен.
Механизм действия обусловлен активацией аденилатциклазы внутренней поверхности клеточных мембран, повышением внутриклеточной концентрации ц-АМФ ии Са2+ . Первая фаза действия обусловлена, прежде всего, стимуляцией β-адренорецепторов различных органов и проявляется тахикардией, повышением сердечного выброса, возбудимости и проводимости миокарда, артериоло- и бронходилатацией, снижением тонуса матки, мобилизацией гликогена из печени и жирных кислот из жировых депо. Во второй фазе происходит возбуждение а-адренорецепторов, что приводит к сужению сосудов органов брюшной полости, кожи, слизистых оболочек (скелетных мышц — в меньшей степени), повышению артериального давления (главным образом — систолитического), общего периферического сопротивления сосудов.
Эффективность лекарственного средства зависит от дозы. В очень низких дозах, при скорости введения меньше 0,01 мкг/кг/мин, может снижать артериальное давление вследствие расширения сосудов скелетной мускулатуры. При скорости введения 0,04-0,1 мкг/кг/мин увеличивает частоту и силу сердечных сокращений, ударный объем крови и минутный объем крови, снижает общее периферическое сопротивление сосудов; выше 0,2 мкг/кг/мин сужает сосуды, повышает артериальное давление (главным образом — систолическое) и общее периферическое сопротивление сосудов. Прессорный эффект может вызывать кратковременное—рефлекторное замедление частоты сердечных сокращений. Расслабляет гладкие мышцы бронхов. Дозы выше 0,3 мкг/кг/мин снижают почечный кровоток, кровоснабжение внутренних органов, тонус и моторику желудочно-кишечного тракта.
Повышает проводимость, возбудимость и автоматизм миокарда. Увеличивает потребность миокарда в кислороде. Ингибирует индуцированное антигенами высвобождение гистамина и лейкотриенов, устраняет спазм бронхиол, предотвращает развитие отека их слизистой оболочки.
Действуя на α-адренорецепторы кожи, слизистых оболочек и внутренних органов вызывает сужение сосудов, снижение скорости всасывания местноанестезирующих средств, увеличивает продолжительность действия и понижает токсическое влияние местной анестезии. Стимуляция β2- адренорецепторов сопровождается усилением выведения калия из клетки и может привести к гипокалиемии. При интракавернозном введении уменьшает кровенаполнение пищеристых тел.
Расширяет зрачки, способствует снижению продукции внутриглазной жидкости и внутриглазного давления. Вызывает гипергликемию (усиливает гликогеногенез и глюконеогенез) и повышает содержание в плазме крови свободных жирных кислот, улучшает тканевый обмен. Слабо стимулирует центральную нервную систему, проявляет противоаллергическое и противовоспалительное действие.
Терапевтический эффект развивается практически мгновенно при внутривенном введении (продолжительность действия -1-2 минуты), через 5-10 минут после подкожного введения (максимальный эффект — через 20 минут), при внутримышечном введении время начала эффекта вариабельно.
Фармакокинетика. При внутримышечном или подкожном введении быстро всасывается; максимальная концентрация в крови достигается через 3-10 минут. Проникает через плацентарный барьер, в грудное молоко, не проникает через гематоэнцефалический барьер. Метаболизируется моноаминоксидазой ( в ванилилминдальную кислоту) и катехол-О- метилтрансферазой ( в метанефрин) в клетках печени, почек, слизистой оболочки кишечника, аксонах. Период полувыведения при внутривенном введении составляет 1-2 минуты. Экскреция метаболитов осуществляется почками.
В защищенном от света и недоступном для детей месте, при температуре не выше 25 °C.
2 года. Не применять по истечении срока годности.
Раствор для инъекций 1,8 мг/мл по 1 мл в ампулах.
По 5 ампул с лекарственным средством помещают во вкладыш из плёнки поливинилхлоридной.
По 2 вкладыша, листок-вкладыш по применению и нож ампульный или скарификатор ампульный помещают в пачку из картона.
При использовании ампул с точкой, насечкой, кольцом разлома нож ампульный или скарификатор не вкладывают.
Предприятие-производитель
СОАО «Ферейн»
Республика Беларусь, г. Минск, пер. С. Ковалевской, д. 52а, тел. 213-16-37.
АДРЕНАЛИН
Adrenaline
Регистрационный номер
Торговое наименование
АДРЕНАЛИН
Международное непатентованное наименование
Лекарственная форма
раствор для инъекций
Состав
Описание
Прозрачный бесцветный или слегка окрашенный раствор.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Симпатомиметик, действующий на α- и β-адренорецепторы. Действие обусловлено активацией рецепторзависимой аденилатциклазы на внутренней поверхности клеточной мембраны, повышением внутриклеточной концентрации циклического аденозинмонофосфата (цАМФ) и ионов кальция (Ca2+). В очень низких дозах, при скорости введения меньше 0,01 мкг/кг/мин может снижать артериальное давление вследствие расширения сосудов скелетной мускулатуры. При скорости введения 0,04–0,1 мкг/кг/мин увеличивает частоту и силу сердечных сокращений, ударный объём крови и минутный объём крови, снижает общее периферическое сосудистое сопротивление; выше 0,02 мкг/кг/мин сужает сосуды, повышает артериальное давление (главным образом, систолическое) и общее периферическое сосудистое сопротивление. Прессорный эффект может вызывать кратковременное рефлекторное замедление частоты сердечных сокращений.
Расслабляет гладкие мышцы бронхов. Дозы выше 0,3 мкг/кг/мин снижают почечный кровоток, кровоснабжение внутренних органов, тонус и моторику желудочно-кишечного тракта.
Расширяет зрачки, способствует снижению продукции внутриглазной жидкости и внутриглазного давления. Вызывает гипергликемию (усиливает гликогенолиз и глюконеогенез) и повышает содержание в плазме свободных жирных кислот.
Повышает проводимость, возбудимость и автоматизм миокарда. Увеличивает потребность миокарда в кислороде.
Ингибирует индуцированное антигенами высвобождение гистамина и лейкотриенов, устраняет спазм бронхиол, предотвращает развитие отёка их слизистой оболочки.
Действуя на α-адренорецепторы, расположенные в коже, слизистых оболочках и внутренних органах, вызывает сужение сосудов, снижение скорости всасывания местноанестезирующих средств, увеличивает продолжительность и снижает токсическое влияние местной анестезии.
Стимуляция β2-адренорецепторов сопровождается усилением выведения ионов калия (K+) из клетки и может привести к гипокалиемии.
При интракавернозном введении уменьшает кровенаполнение пещеристых тел. Терапевтический эффект развивается практически мгновенно при внутривенном введении (продолжительность действия — 1–2 мин), через 5–10 мин после подкожного введения (максимальный эффект — через 20 мин), при внутримышечном введении — время начала эффекта вариабельное.
Фармакокинетика
Всасывание
При внутримышечном или подкожном введении хорошо всасывается. Введённый парентерально. быстро разрушается. Также абсорбируется при эндотрахеальном и конъюнктивальном введении. Время достижения максимальной концентрации в крови при подкожном и внутримышечном введении — 3–10 мин. Проникает через плаценту, в грудное молоко, не проникает через гематоэнцефалический барьер.
Метаболизм
Метаболизируегся в основном моноаминооксидазой и катехол-О-метилтрансферазой в окончаниях симпатических нервов и других тканей, а также в печени с образованием неактивных метаболитов. Период полувыведения при внутривенном введении — 1–2 мин.
Выведение
Выводится почками в основном в виде метаболитов: ванилилминдальной кислоты, сульфатов, глюкуронидов, а также в незначительном количестве — в неизменённом виде.
Показания
Препарат Адреналин показан к применению у взрослый, новорождённый, младенцев, детей и подростков в возрасте от 0 до 18 лет в следующих случаях:
- аллергические реакции немедленного типа (в том числе крапивница, ангионевротический отёк, анафилактический шок), развивающиеся при применении лекарственных средств, сывороток, переливании крови, употреблении пищевых продуктов, укусах насекомых или введении других аллергенов.
- Бронхиальная астма (купирование астматического статуса), бронхоспазм во время наркоза, астма физического усилия.
- Асистолия (в том числе на фоне остро развивающейся атриовентрикулярной блокады III степени).
- Кровотечение из поверхностных сосудов кожи и слизистых оболочек (в том числе из дёсен).
- Артериальная гипотензия, не поддающаяся воздействию адекватных объёмов замещающих жидкостей (в том числе шок, бактериемия, операции на открытом сердце, почечная недостаточность).
- Необходимость удлинения действия местных анестетиков.
- Эпизоды полной атриовентрикулярной блокады (с развитием синкопального состояния (с индром Морганьи-Адамса-Стокса)).
- Остановка кровотечения (как сосудосуживающее средство).
Противопоказания
- Гиперчувствительность кэпинефрину или к любому из вспомогательных веществ препарата;
- гипертрофическая обструктивная кардиомиопатия;
- тахиаритмия;
- фибрилляция желудочков;
- хроническая сердечная недостаточность 3–4 функционального класса;
- феохромоцитома;
- острая и хроническая артериальная недостаточность;
- гиперкалиемия;
- шок неаллергического генеза (в том числе кардиогенный, травматический, геморрагический);
- холодовая травма;
- органические повреждения головного мозга;
- закрыто угольная глаукома;
- беременность;
- период грудного вскармливания;
- детский возраст до 18 лет (кроме состояний, непосредственно угрожающих жизни);
- одновременное применение ингаляционных средств для общей анестезии (галотана). Эпинефрин в комбинации с местными анестетиками не применяют для местной анестезии пальцев рук и ног из-за риска ишемического повреждения тканей.
При неотложных состояниях все противопоказания являются относительные.
С осторожностью
Метаболический ацидоз, ишемическая болезнь сердца, артериальная гипертензия, гиперкапния, гипоксия, фибрилляция предсердий, желудочковая аритмия: лёгочная гипертензия, гиповолемия, инфаркт миокарда, окклюзионные заболевания сосудов (в том числе в анамнезе — артериальная эмболия, атеросклероз, болезнь Бюргера, диабетический эндартериит, болезнь Рейно), сахарный диабет, гипертиреоз, давняя бронхиальная астма и эмфизема, церебральный атеросклероз, болезнь Паркинсона, тетраплегия, судорожный синдром, гиперплазия предстательной железы и/или трудности при мочеиспускании; пожилой возраст, парезы и параличи, повышение сухожильных рефлексов при травме спинного мозга.
Применение при беременности и в период грудного вскармливания
Строго контролируемых исследований применения эпинефрина у беременных не проведено. Эпинефрин проникает через плаценту. Установлена статистически закономерная взаимосвязь появлений пороков развития и паховой грыжи у детей при применении адреналина у беременных, особенно в первом триместре или на протяжении всей беременности, имеется сообщение о единичном случае возникновения аноксии у плода (при внутривенном введении эпинефрина). Инъекция эпинефрина может вызвать у плода тахикардию, нарушения сердечного ритма, в том числе дополнительные систолические удары и т.п. Эпинефрин не следует применять беременным при артериальном давлении выше 130/80 мм рт. ст. Опыты на животных показали, что при введении в дозах, в 25 раз превышающих рекомендуемую дозу для человека, эпинефрин вызывает тератогенный эффект. Эпинефрин следует использовать во время беременности, только если потенциальная польза для матери превышает возможный риск для плода. Применение для коррекции гипотензии во время родов не рекомендуется, поскольку может задерживать вторую стадию родов; при введении в больших дозах для ослабления сокращения матки может вызвать длительную атонию матки с кровотечением. Эпинефрин не следует использовать во время родов, применение возможно только в том случае, если требуется назначение его по жизненным показаниям.
Если лечение эпинефрином необходимо в период кормления грудью, то грудное вскармливание должно быть прекращено.
Способ применения и дозы
Подкожно, внутримышечно, внутривенно капельно.
Аллергические реакции немедленного типа (анафилактический шок): внутривенно медленно 0,1-0,25 мг, разведённых в 10 мл 0,9 % раствора натрия хлорида, при необходимости продолжают внутривенное капельное введение в концентрации 1:10000. При отсутствии непосредственной угрозы жизни предпочтительнее введение внутримышечное или подкожное 0,3–0,5 мг, при необходимости повторное введение через 13–20 мин до 3 раз.
Бронхиальная астма: подкожно 0,3–0,5 мг, при необходимости повторные дозы можно вводить через каждые 20 мин до 3 раз, или внутривенно по 0,1–0,25 мг с разведением в концентрации 1:10000.
При асистолии: внутрисердечно 0,5 мг (разбавляют 10 мл 0,9 % раствора натрия хлорида или другим раствором); во время реанимационных мероприятий — по 0,5–1,0 мг (в разбавленном виде) внутривенно каждые 3–5 мин. Если пациент интубирован, возможна эндотрахеальная инстилляция — дозы должны в 2–2,5 раза превышать дозы для внутривенного введения.
Остановка кровотечений: местно в виде тампонов, смоченных раствором препарата.
При артериальной гипотензии: внутривенно капельно 1 мкг/мин, скорость введения можно увеличить до 2–10 мкг/мин.
Для удлинения действия местных анестетиков: в концентрации 0,005 мг/мл (доза зависит от вида используемого анестетика), для спинномозговой анестезии — 0,2–0,4 мг.
Синдром Морганьи-Адамса-Стокса (брадиаритмическая форма): в дозе 1 мг в 250 мл 5 % раствора глюкозы внутривенно, постепенно увеличивая скорость инфузии до достижения минимального достаточного числа сердечных сокращений.
Как сосудосуживающее средство: внутривенно капельно 1 мкг/мин, скорость введения можно увеличить до 2–10 мкг/мин.
Применение в детской практике:
Новорождённые (асистолия): внутривенно. 10–30 мкг/кг каждые 3–5 мин, медленно.
Детям старше 1 месяца: внутривенно, 10 мкг/кг (в последующем при необходимости каждые 3–5 мин вводят по 100 мкг/кг (после введения, по крайней мере, 2 стандартных доз можно каждые 5 мин использовать более высокие дозы — 200 мкг/кг)). Можно использовать эндотрахеальное введение.
Детям при анафилактическом шоке: подкожно или внутримышечно по 0,01 мг/кг (максимально — до 0,3 мг), при необходимости введение этих доз повторяют через каждые 15 мин (до 3 раз).
Детям при бронхоспазме: подкожно 10 мкг/кг (максимально — до 0,3 мг), дозы при необходимости повторяют каждые 15 мин (до 3–4 раз) или каждые 4 ч.
Побочное действие
Классификация частоты развития побочных эффектов согласно Всемирной Организации Здравоохранения (ВОЗ): очень часто (≥1/10); часто (от ≥1/100 до <1/10); не часто (от ≥1/1000 до <1/100); редко (от ≥1/10000 до <1/1000); очень редко (от <1/10000, включая отдельные сообщения).
Нарушения со стороны иммунной системы: нечасто — ангионевротический отёк, бронхоспазм, кожная сыпь, многоформная эритема.
Психические нарушения: часто — тревожное состояние, нечасто — нервозность, расстройства личности (психомоторное возбуждение, дезориентация, нарушение памяти, психотические расстройства: агрессивное или паническое поведение, шизофреноподобные расстройства, паранойя).
Нарушения со стороны нервной системы: часто — головная боль, тремор, тик; нечасто — головокружение, усталость, нарушение сна, мышечные подёргивания.
Нарушения со стороны сердца: нечасто — стенокардия, брадикардия или тахикардия, ощущение сердцебиения, повышение или снижение артериального давления, при высоких дозах — желудочковые аритмии (включая фибрилляцию желудочков); редко — аритмия, боль в грудной клетке, отёк лёгких.
Нарушения со стороны сосудов: нечасто — повышение или понижение артериального давления; редко — отёк лёгких.
Желудочно-кишечные нарушения: нечасто — тошнота, рвота.
Нарушения со стороны кожи и подкожных тканей: нечасто — повышенное потоотделение.
Нарушения со стороны почек и мочевыводящих путей: редко — затруднённое и болезненное мочеиспускание (при гиперплазии предстательной железы).
Общие нарушения и реакции в месте введения: нечасто — боль или жжение в месте внутримышечной инъекции.
Лабораторные и инструментальные данные: редко — гипокалиемия.
Передозировка
Симптомы: чрезмерное повышение артериального давления, тахикардия, сменяющаяся брадикардией, нарушения ритма (в том числе фибрилляция предсердий и желудочков), похолодание и бледность кожных покровов, рвота, головная боль, метаболический ацидоз, инфаркт миокарда, черепно-мозговое кровоизлияние (особенно у пожилых пациентов), отёк лёгких, смерть.
Лечение: прекратить введение, симптоматическая терапия — для снижения артериального давления — α-адреноблокаторы (фентоламин), при аритмии — β-адреноблокаторы (пропранолол).
Взаимодействие с другими лекарственными средствами
Антагонистами эпинефрина являются блокаторы α- и β-адренорецепторов.
Эффективность применения эпинефрина снижена у пациентов с тяжёлыми анафилактическими реакциями, принимающих β-адреноблокаторы. В этом случае внутривенно применяют сальбутамол.
Применение совместно с другими адреномиметиками может усилить эффект эпинефрина. Ослабляет эффекты наркотических анальгетиков и снотворных препаратов.
При применении одновременно с сердечными гликозидами, хинидином, трициклическими антидепрессантами, допамином, средствами для ингаляционного наркоза (энфлуран, галотан, изофлуран, метоксифлуран), кокаином возрастает риск развития аритмий (вместе применять следует крайне осторожно или вообще не применять); с другими адреномиметиками — усиление выраженности побочных эффектов со стороны сердечно-сосудистой системы; с гипотензивными средствами — снижение их эффективности.
С диуретиками — возможно увеличение прессорного эффекта эпинефрина.
Одновременное применение с препаратами, ингибирующими моноаминооксидазу (прокарбазин, селегилин, а также фуразолидон), может вызывать внезапное и выраженное повышение артериального давления, гиперпиретический криз, головную боль, аритмии сердца, рвоту; с нитратами — ослабление их терапевтического действия. С феноксибензамином — усиление антигипертензивного действия и тахикардию: с фенитоином — внезапное снижение артериального давления и брадикардию (зависит от дозы и скорости введения); с препаратами гормонов щитовидной железы — взаимное усиление действия.
С лекарственными средствами, удлиняющими интервал QT: с антиаритмическими препаратами (такими, как лидокаин, амиодарон, соталол и др.), с антибиотиками (такими, как эритромицин, левофлоксацин и др.), с антигистаминными препаратами (такими, как лоратадин, димедрол и др.), с трициклическими и тетрациклическими антидепрессантами (такими, как амитриптилин, имипрамин, сертралин, хлорпромазин и др.), с нейролептиками (такими, как галоперидол, рисперидон и др.), с антагонистами дофаминовых рецепторов (такими, как домперидон др.), с антималярийными препаратами (такими, как хлорохин, мефлохин и др.), с противогрибковыми препаратами (такими, как кетоконазол, флуконазол и др.), с антигипертензивными препаратами (такими, как индапамид, эфедрин и др.), — может вызывать удлинение интервала QT.
Одновременное применение с диатриазиатами, йогаламовой или йоксагловой кислотами — усиление неврологических эффектов, с алкалоидами спорыньи — усиление вазоконстрикторного эффекта (вплоть до выраженной ишемии и развития гангрены).
Снижает эффект инсулина и других гипогликемических лекарственных средств.
Особые указания
Безопасность применения в отношении почек
Эпинефрин вызывает сужение почечных артериол, что может привести к олигурии и почечной недостаточности.
Безопасность применения в отношении сердечно-сосудистой системы и мозгового кровообращения
Эпинефрин может вызывать нарушения сердечного ритма и ишемию миокарда, особенно у пациентов с ишемической болезнью сердца или кардиомиопатией.
Эпинефрин увеличивает сердечный выброс и вызывает сужение периферических сосудов, что может привести к развитию отёка лёгких.
Нельзя вводить препарат в сосуды пальцев, кистей рук и стоп, так как эпинефрин является мощным вазоконстриктором и может привести к нарушению кровоснабжения и некрозу тканей (гангрене).
Кожные реакции
Описаны редкие случаи тяжёлых инфекций кожи и мягких тканей, включая вызванный Clostridia некротизирующий фасциит и некроз мышц (газовую гангрену), в месте введения эпинефрина для лечения анафилаксии. Пациенты должны быть предупреждены о необходимости немедленно обратиться за медицинской помощью при возникновении таких симптомов инфекции, как стойкое покраснение, повышение температуры кожи, отёк или болезненность в месте введения эпинефрина.
В период лечения рекомендовано определение концентрации ионов калия в сыворотке крови, измерение артериального давления, диуреза, минутного объёма кровотока, ЭКГ, центрального венозного давления, давления в лёгочной артерии и давления заклинивания в лёгочных капиллярах.
Чрезмерные дозы эпинефрина при инфаркте миокарда могут усилить ишемию путём повышения потребности миокарда в кислороде.
Увеличивает уровень глюкозы в плазме крови, в связи с чем при сахарном диабете требуются более высокие дозы инсулина и производных сульфонилмочевины.
Эпинефрин нецелесообразно применять длительно (сужение периферических сосудов, приводящее к возможному развитию некроза или гангрены).
Применение для коррекции артериальной гипотензии во время родов не рекомендуется, поскольку может задерживать вторую стадию родов; при введении в больших дозах для ослабления сокращения матки может вызвать длительную атонию матки с кровотечением. При прекращении лечения дозы следует уменьшать постепенно, так как внезапная отмена терапии может приводить к тяжёлой артериальной гипотензии.
Легко разрушается щелочами и окисляющими средствами. Метабисульфит натрия, входящий в состав препарата, может вызвать аллергическую реакцию, включая симптомы анафилаксии и бронхоспазм, особенно у пациентов с астмой или аллергией в анамнезе. Эпинефрин следует применять с осторожностью у пациентов с тетраплегией из-за повышения чувствительности таких лиц к эпинефрину.
Резкое повышение артериального давления при применении адреналина может приводить к развитию кровоизлияния, особенно у пожилых пациентов с сердечно-сосудистыми заболеваниями.
У пациентов с болезнью Паркинсона могут наблюдаться психомоторное возбуждение или временное ухудшение симптомов заболевания при применении адреналина, в связи с чем необходимо соблюдать осторожность при применении адреналина у данной категории лиц.
Не вводить повторно в одни и те же участки, во избежание развития некроза тканей. Не рекомендуется введение препарата в ягодичные мышцы.
Следует с осторожностью применять эпинефрин у пожилых пациентов, пациентов с ишемической болезнью сердца, артериальной гипертензией, сахарным диабетом, гипертиреозом, гиперплазией предстательной железы и нарушением мочеиспускания.
Необходимо соблюдать особую осторожность при применении эпинефрина у пациентов с длительно существующей бронхиальной астмой, эмфиземой лёгких и органическим поражением сердца (лёгочным сердцем).
Внутримышечное введение эпинефрина следует осуществлять в переднебоковую поверхность бедра (в латеральную широкую мышцу бедра). Введение препарата в мышцы меньшего размера (например, в дельтовидную мышцу) не рекомендуется.
Не применять препарат при изменении цвета или появлении осадка в растворе. Неиспользованную часть раствора следует утилизировать.
Вспомогательные вещества
Препарат Адреналин содержит натрия метабисульфит, который может изредка вызывать тяжелые реакции гиперчувствительности и бронхоспазм.
Данный препарат содержит менее 1 ммоль (23 мг) натрия на один мл раствора, то есть по сути не содержит натрия.
Влияние на способность управлять транспортными средствами, механизмами
После применения препарата врач должен индивидуально, в каждом конкретном случае, решать вопросы о допуске пациента к управлению транспортом или занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторный реакций.
Форма выпуска
Раствор для инъекций, 1 мг/мл.
По 1 мл в ампулы светозащитного нейтрального стекла марки СНО-1 или из стекла с классом сопротивления гидролизу HGA1 (первый гидролитический).
5 ампул помещают в контурную ячейковую упаковку из плёнки поливинилхлоридной (ПВХ) либо из плёнки полиэтилентерефталатной (ПЭТФ).
1 или 2 контурные ячейковые упаковки вместе с инструкцией по применению и скарификатором ампульным помещают в пачку из картона.
5 или 10 ампул вместе с инструкцией по применению и скарификатором ампульным помещают в пачку из картона с гофрированным вкладышем.
Упаковка для стационаров
«4, 5 или 10 контурных ячейковых упаковок вместе с инструкциями г.о применению в количестве, равном количеству контурных ячейковых упаковок, помещают в пачку из картона. 50 или 100 контурных ячейковых упаковок вместе с инструкциями по применению в количестве, равном количеству контурных ячейковых упаковок, помещают в коробку из картона гофрированного.
При упаковке ампул с точкой или кольцом излома скарификатор ампульный не вкладывают.
Хранение
В защищённом от света месте, при температуре не выше 25 °C. Хранить в недоступном для детей месте.
Срок годности
3 года. Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту
Производитель
Эллара, ООО, Российская Федерация
Наименование и адрес производителя
Российская Федерация
ООО «Эллара»
601122, Владимирская обл., Петушинский район, г. Покров, ул. Франца Штольверка, д. 20, стр. 2
Владелец регистрационного удостоверения и организация, принимающая претензии потребителей
Российская Федерация
ООО «Эллара»
601122, Владимирская обл., Петушинский район, г. Покров, ул. Франца Штольверка, д. 20
Тел./факс: (49243) 6-42-22, (49243) 6-42-24
E-mail: info@ellara.ru